Теоретические основы химической технологии, 2021, T. 55, № 4, стр. 428-441
Процессы парциального окисления и окислительного дегидрирования легких алканов — основных компонентов природного и попутных нефтяных газов — рассматриваются как перспективная альтернатива существующим технологиям получения основных полупродуктов органического и нефтехимического синтеза из нефтяного сырья [ 1 ]. Особое место среди них занимает окислительная конденсация метана ОКМ с получением высших углеводородов, включая этилен [ 2 — 6 ]. С одной стороны, метан является наиболее распространенным и дешевым углеводородным сырьем. С другой стороны, этилен — один из наиболее востребованных и дефицитных полупродуктов нефтехимии.


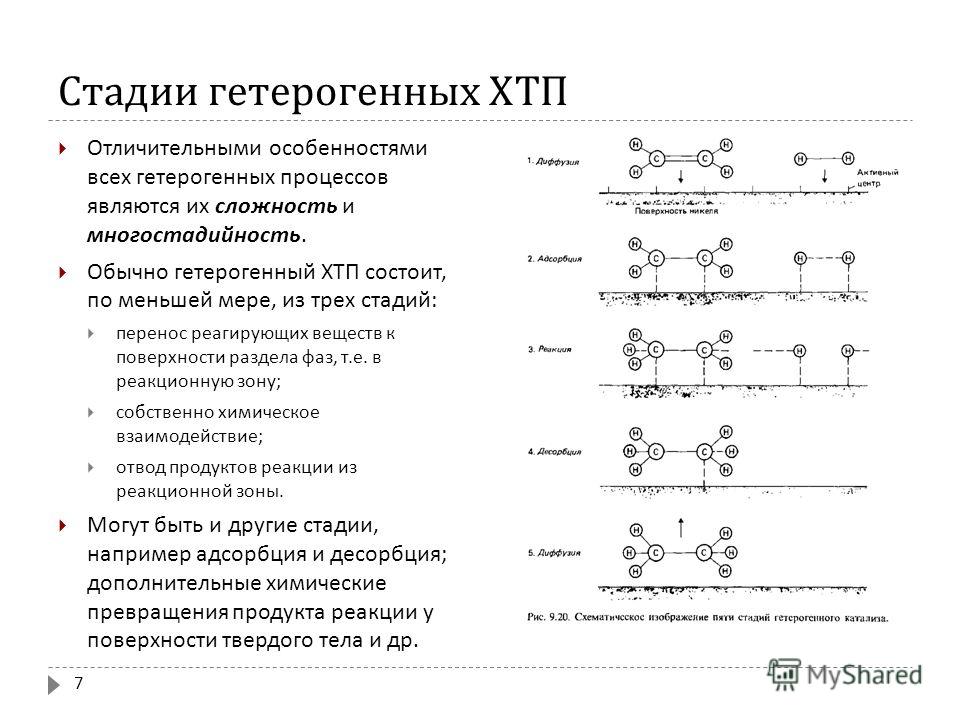
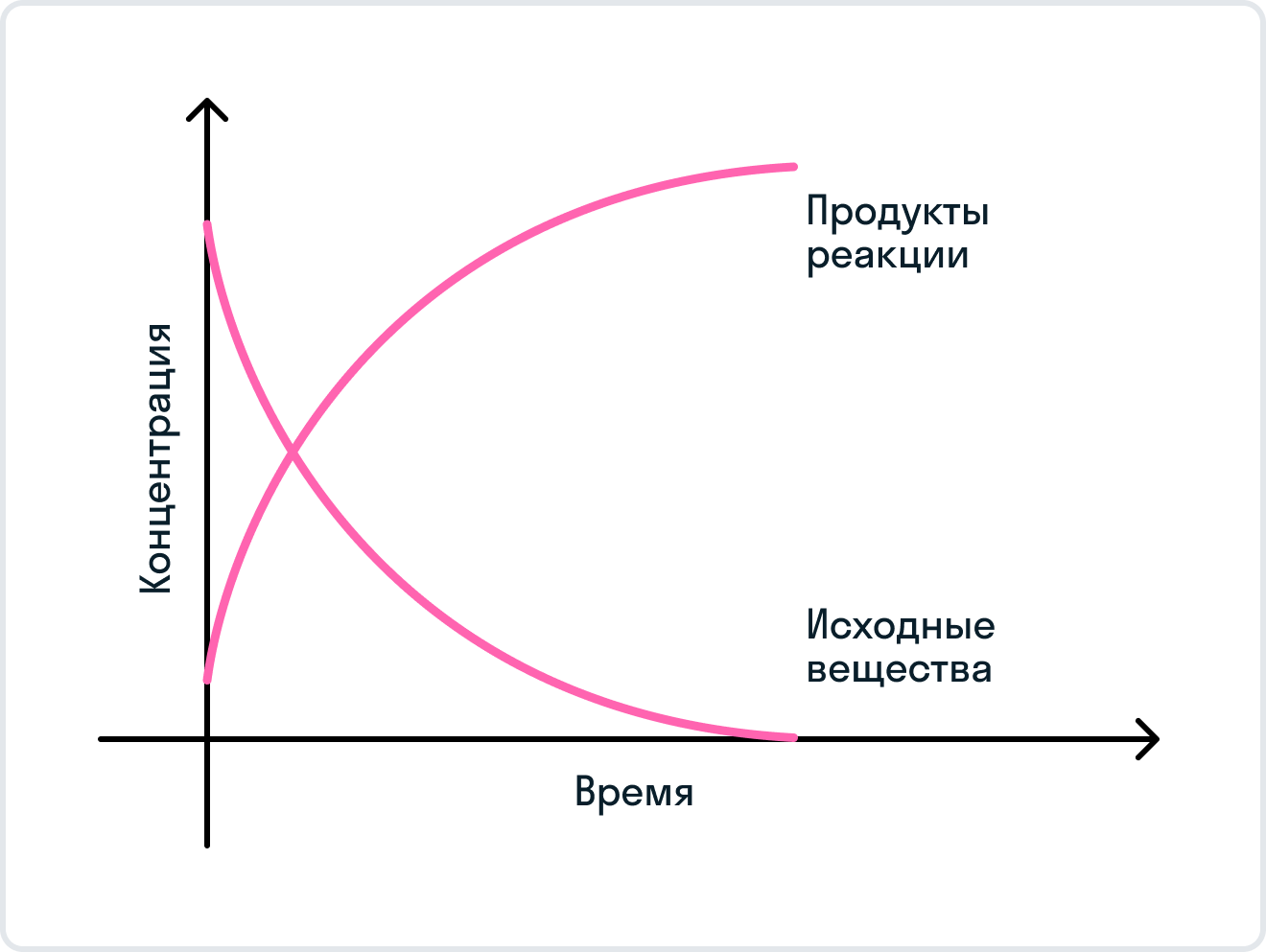
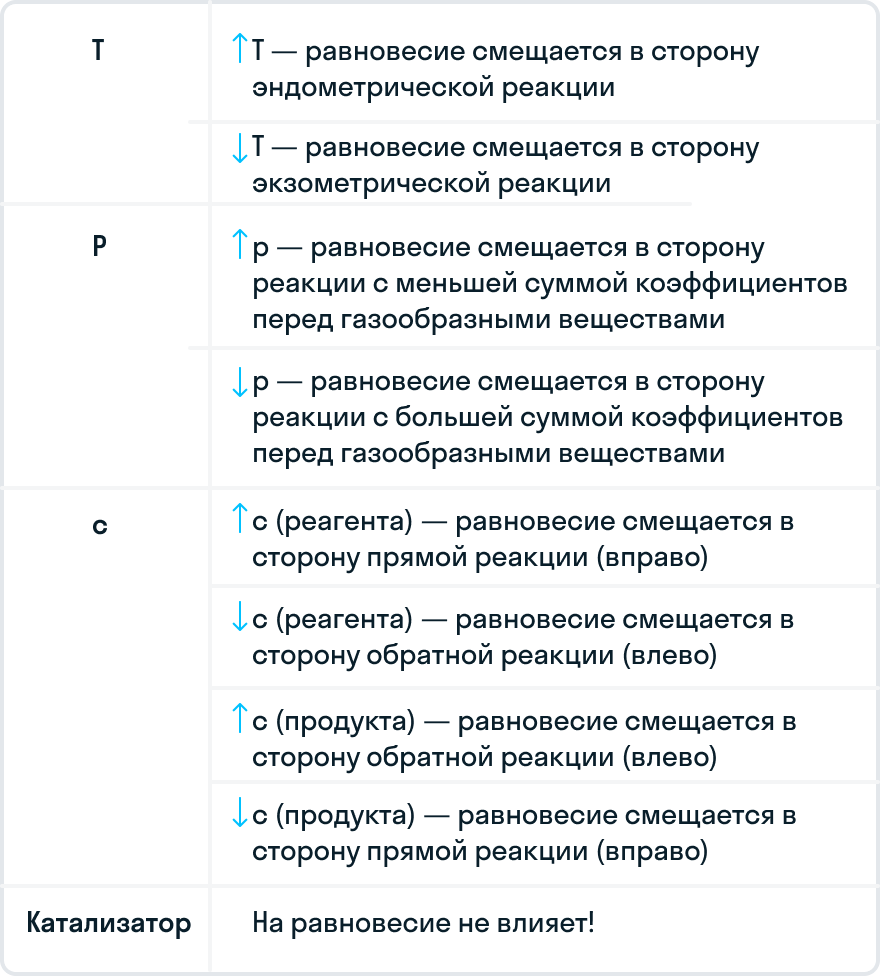


Скорость химических реакций. Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой. Химические реакции протекают с различными скоростями. Некоторые из них заканчиваются за секунды, другие - за минуты, часы, дни; некоторые для своего протекания требуют десятилетий. Кроме того, одна и та же реакция может протекать быстро при повышенных температурах и медленно — при охлаждении.









| 350 | Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов. | |
| 155 | Гетерогенные реакции Гетерогенные реакции протекают на границе поверхности раздела фаз, например между веществами, находящимися в жидкой и твердой фазах. Любые гетерогенные процессы связаны с переносом вещества, и в них можно выделить три стадии:. | |
| 336 | Процессы, характерные для химической электротермии, такие как получение карбида кремния, фосфора и т. | |
| 270 | Чтобы получить доступ к этому сайту, вы должны разрешить использование JavaScript. Моя панель информации Русский как неродной Страницы Урок 6 Кинетика химических реакций. | |
| 423 | Различают следующие типы гетерогенных процессов:. Для взаимодействия реагентов в гетерогенной системе необходим перенос вещества из одной фазы в другую. | |
| 57 | Скорость химической реакции зависит от условий, в которых она протекает. Рассматриваемые ниже факторы, влияющие на скорость протекания реакций, относятся к гомогенным реакциям. | |
| 222 | Зависимость скорости химической реакции от концентрации реагирующих веществ выражает закон действующих масс:. | |
| 176 | Главный фактор — природа реагирующих веществ — характер связи между атомами в молекулах реагентов. | |
| 152 | Раздел химии, изучающий изменение химических систем во времени, называется химической кинетикой. В гомогенных однородных системах в растворе или в газовой фазе скорость химической реакции определяется изменением молярной концентрации одного из реагирующих веществ в единицу времени:. |
Скоростью реакции называется число актов химического взаимодействия, происходящих в единицу времени в единице объёма при гомогенных процессах или на единице поверхности при гетерогенных процессах. Особенности гетерогенных реакций обусловлены участием в них конденсированных фаз. Это затрудняет перемешивание и транспорт реагентов и продуктов; возможна активация молекул реагентов на поверхности раздела фаз. Кинетика любой гетерогенные реакции определяется как скоростью самого химического превращения, так и процессами переноса диффузией , необходимыми для восполнения расхода реагирующих веществ и удаления из реакционной зоны продуктов реакции. В отсутствие диффузионных затруднений скорость гетерогенной реакции пропорциональна размерам реакционной зоны; так называемая удельная скорость реакции, рассчитанная на единицу поверхности или объема реакционной зоны, не изменяется во времени; для простых одностадийных реакций она может быть определена на основе действующих масс закона. Этот закон не выполняется, если диффузия веществ протекает медленнее, чем химическая реакция; в этом случае наблюдаемая скорость гетерогенные реакции описывается уравнениями диффузионной кинетики.